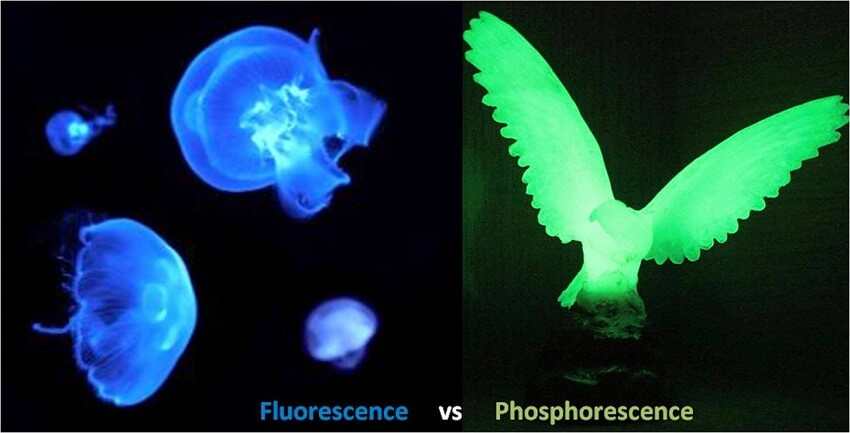
Que sont la fluorescence, la phosphorescence et la luminescence ? Nous les associons tous à l’effet de brillance, mais qu’est-ce qui les distingue les uns des autres ? Bien que ces mécanismes par lesquels les choses brillent soient tous physiquement liés et puissent tous être regroupés dans la luminescence, ils sont fondamentalement différents dans le mécanisme physique sous-jacent ainsi que dans les effets.
Luminescence
L’explication simple
Trois formes principales de luminescence sont en jeu : la fluorescence, la phosphorescence et la chimioluminescence. La fluorescence et la phosphorescence sont deux formes de photoluminescence. Dans la photoluminescence, la lueur d’une substance est déclenchée par la lumière, contrairement à la chimiluminescence, où la lueur est provoquée par une réaction chimique. La fluorescence et la phosphorescence reposent toutes deux sur la capacité d’une substance à absorber la lumière et à émettre une lumière de plus grande longueur d’onde et donc de plus faible énergie. La principale différence réside dans le temps qu’elle met à le faire. Dans le cas de la fluorescence, l’émission est essentiellement immédiate et n’est donc généralement visible que si la source lumineuse est allumée en permanence (comme les lampes UV), tandis que les matériaux phosphorescents peuvent stocker l’énergie lumineuse absorbée pendant un certain temps et libérer la lumière plus tard, ce qui donne lieu à une rémanence qui persiste après l’extinction de la lumière. Selon le matériau, cette rémanence peut durer de quelques secondes à plusieurs heures.
Si elle disparaît immédiatement, il s’agit de fluorescence. Si elle persiste, c’est de la phosphorescence. Et si elle doit être activée, c’est de la chimiluminescence. C’est simple !
Imaginez une scène dans une boîte de nuit : les dents, les yeux et le tissu qui brillent sous la lumière noire sont fluorescents, le panneau de sortie de secours est phosphorescent et les bâtons lumineux sont chimioluminescents. La lumière produite par le bâton lumineux est le résultat de deux produits chimiques qui ont été mélangés lorsqu’une petite capsule dans le bâton a été brisée et mélangée en secouant le bâton.
L’explication complexe
« Mais comment cela fonctionne-t-il exactement ? » demandez-vous ? Préparez-vous à plonger dans vos dernières connaissances en physico-chimie. Pour comprendre les principes qui expliquent pourquoi les molécules absorbent et émettent de la lumière, nous devons d’abord nous pencher sur les électrons et comprendre leurs états fondamental et excité ainsi que le spin des électrons, des concepts qui ne sont pas encore totalement compris par la mécanique quantique moderne.
Photoexcitation
Une condition préalable à la photoluminescence, qu’il s’agisse de fluorescence ou de phosphorescence, est la capacité d’une molécule à absorber un rayonnement lumineux conduisant à une excitation électronique. Un électron lié à une molécule absorbe un photon et donc son énergie et devient excité. Il passe de l’état fondamental (S0) à un état excité (Sn) instantanément (~10-15 sec). L’excitation peut amener l’électron à occuper une variété de niveaux vibratoires différents (v=n) de l’état excité, en fonction de la longueur d’onde exacte du photon absorbé. Les états électroniquement excités qui en résultent sont intrinsèquement instables et les électrons se relaxeront pour revenir à leur état fondamental par plusieurs combinaisons d’étapes mécaniques, dissipant l’énergie de différentes manières au cours du processus.
La relaxation vibrationnelle est extrêmement rapide (10-12 à 10-10 sec) et conduit à la dissipation de l’énergie au sein d’un état excité par l’énergie vibrationnelle, qui est rapidement dissipée sous forme de chaleur aux molécules voisines. Comme l’énergie n’est pas dissipée par l’émission de lumière, la relaxation vibratoire est une transition non radiative.
La conversion interne est une autre transition non radiative, qui est iso-énergétique et également rapide (10-14 à 10-11 sec). Elle décrit la transition d’un état électroniquement excité (Sn+1) vers un état vibrationnel d’un état excité inférieur (Sn) du même niveau énergétique. Aucune énergie n’est dissipée pendant la transition. Un électron peut dissiper entièrement l’énergie initialement absorbée par la relaxation vibratoire et la conversion interne uniquement. Dans ce cas, le processus de relaxation sera entièrement non radiatif et la molécule ne sera ni fluorescente ni phosphorescente et toute l’énergie absorbée sera dissipée par la chaleur. La probabilité que des événements radiatifs se produisent par rapport à une relaxation entièrement non radiative définit le rendement quantique d’un fluorophore et, par conséquent, sa luminosité.
Fluorescence
Un mécanisme radiatif par lequel les électrons excités peuvent se relaxer est une transition lumineuse de l’état excité le plus bas (S1) à l’état fondamental (S0) dans un processus rapide (10-9 à 10-6 sec) appelé fluorescence. La différence d’énergie est dissipée par l’émission d’un photon. L’électron ayant perdu une partie de son énergie d’excitation initiale par relaxation vibratoire, le photon émis sera de plus faible énergie et donc de plus grande longueur d’onde.
Comme pour l’excitation, l’émission peut généralement se relaxer à différents niveaux vibratoires (v=n) de l’état fondamental (S0), ce qui donne lieu à une bande passante de longueurs d’onde possibles pour le photon émis. Les électrons se relaxent à partir de niveaux vibratoires plus élevés (v=n) jusqu’à l’état sans vibration (v=0) par relaxation vibratoire non radiative, si nécessaire. La longueur d’onde émise résultante est indépendante de la longueur d’onde d’excitation, car généralement les molécules excitées se désintègrent jusqu’au niveau vibrationnel le plus bas de l’état excité le plus bas par des processus non radiatifs avant que l’émission de fluorescence ait lieu. Selon la molécule, la désintégration non radiative peut être responsable de la dissipation d’une partie plus ou moins importante de l’énergie d’excitation, ce qui entraîne des décalages spécifiques à la molécule entre les longueurs d’onde d’excitation et les longueurs d’onde émises. Ce phénomène est appelé décalage de Stokes. La longueur d’onde possible d’un photon qui pourrait être absorbé lors de l’excitation, ainsi que les longueurs d’onde possibles émises – qui varient en raison de la désintégration de la fluorescence sur différents niveaux vibrationnels – définissent ensemble les spectres d’excitation et d’émission d’une molécule. Comme ce sont souvent les mêmes transitions électroniques qui interviennent dans l’excitation et l’émission d’une molécule fluorescente, les spectres d’excitation et d’émission ressemblent souvent à des reflets l’un de l’autre, ce qui est appelé la règle de l’image miroir de la fluorescence.
Phosphorescence
Pour comprendre la différence entre fluorescence et phosphorescence, nous devons faire un petit détour par le spin des électrons. Le spin est une propriété fondamentale et invariable de l’électron et une forme de moment angulaire qui définit son comportement dans un champ électromagnétique. Le spin de l’électron ne peut avoir que la valeur de ½ et l’orientation du spin est soit vers le haut, soit vers le bas. Le spin d’un électron est donc désigné par +½ ou -½, ou alternativement par ↑ ou↓. Deux électrons dans une même orbitale auront toujours un spin antiparallèle à l’état fondamental singlet (S0). Lors de la promotion d’un électron dans l’état excité, l’électron conserve son orientation de spin et un état excité singlet (S1) est formé, où les deux orientations de spin restent appariées comme antiparallèles. Tous les événements de relaxation dans la fluorescence sont neutres en termes de spin et l’orientation du spin de l’électron est maintenue à tout moment.
Cependant, il en va différemment pour la phosphorescence. Le passage rapide (10-11 à 10-6 sec) d’un état excité singulet (S1) à un état excité triplet (T1), énergétiquement favorable, entraîne une inversion du spin de l’électron. Les états excités triplets sont caractérisés par un spin parallèle des deux électrons et sont métastables. La relaxation se produit par phosphorescence, ce qui entraîne une autre inversion du spin de l’électron et l’émission d’un photon. Le retour à l’état fondamental de singulet relaxé (S0) peut se produire après un délai considérable (10-3 à >100 sec). En outre, la quantité d’énergie dissipée par des processus non radiatifs au cours de la relaxation phosphorescente est plus importante que dans le cas de la fluorescence. Ainsi, la phosphorescence est caractérisée par un décalage de Stokes plus important que la fluorescence.
Articles Similaires:
- Pourquoi les électrons ne tombent pas sur le noyau?
- Différence entre chlore et javel?
- Différence entre courant alternatif et continu?
- Différence entre puissance et énergie?
- Différence entre oxygène et dioxygène?
- De quoi est composée la lumière?
- Différence entre volt et ampère?
- Différence entre brume et brouillard?
- Différence entre fusion et fission?
- Différence entre fer et acier?